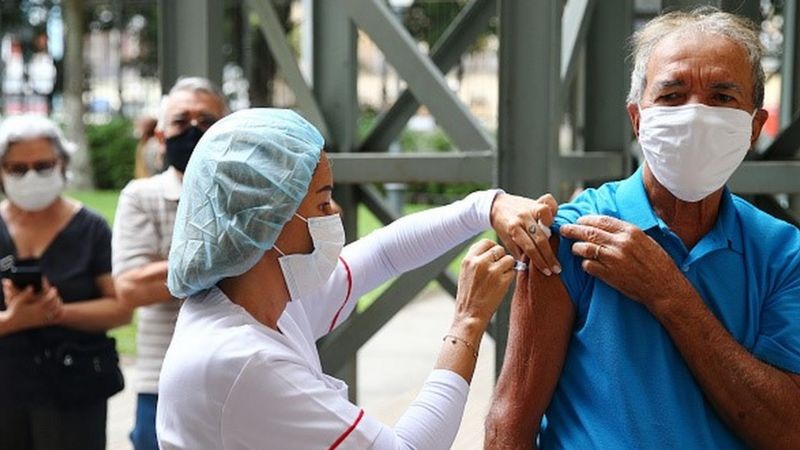
A Bahia passou de cinco para sete unidades de saúde cadastradas para esse tipo de atendimento. As novas unidades ficam em Vitória da Conquista e Porto Seguro, e se unem aos hospitais que já faziam o procedimento em Salvador e Feira de Santana.
O objetivo da medida é fortalecer a rede de acolhimento e melhorar o acesso ao serviço de aborto legal na Bahia. O pedido foi feito para garantir o direito das mulheres e evitar exposições desnecessárias, já que a criminalização do aborto impede que as vítimas procurem seus direitos.
Aborto legal
Atualmente, a Bahia permite o aborto apenas em casos previstos pela lei. São eles: anencefalia (quando o feto não tem encéfalo, ou tem o cérebro subdesenvolvido e o crânio incompleto), gestação que ofereça risco de vida para a mulher, ou que tenha sido decorrente de um estupro. (G1 BA)


.gif)

.gif)